Acide malonique
| Acide malonique | ||

| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | acide propanedioïque | |
| Synonymes |
acide carboxyacétique, |
|
| No CAS | ||
| No ECHA | 100.005.003 | |
| No CE | 205-503-0 | |
| SMILES | ||
| InChI | ||
| Apparence | cristaux blancs[1] | |
| Propriétés chimiques | ||
| Formule | C3H4O4 [Isomères] |
|
| Masse molaire[2] | 104,061 5 ± 0,003 9 g/mol C 34,63 %, H 3,87 %, O 61,5 %, |
|
| pKa | pKa1=2,83 et pKa2=5,69[réf. souhaitée] | |
| Propriétés physiques | ||
| T° fusion | (décomposition) : 135 °C[1] | |
| Solubilité | dans l'eau à 20 °C : 73 g L−1[1] | |
| Masse volumique | 1,6 g cm−3[1] | |
| Pression de vapeur saturante | 0,1 Pa (18,5 °C)[réf. souhaitée] | |
| Précautions | ||
| SIMDUT[3] | ||
 D2B, |
||
| Inhalation | 1,5 mg m−3[réf. souhaitée] | |
| Peau | irritant | |
| Yeux | irritant | |
| Ingestion | nocive R22 | |
| Écotoxicologie | ||
| DL50 | 1 310 mg kg−1 (rat)[réf. souhaitée] | |
| Considérations thérapeutiques | ||
| Classe thérapeutique | Ce poison cellulaire arrête la succinate déshydrogénase. | |
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
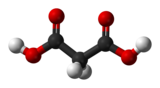
L'acide malonique est un diacide carboxylique aliphatique de formule HOOC-CH2-COOH. Ce composé organique dénommé également acide propanedioïque a été découvert et identifié en 1858 à partir de produits d'oxydation de jus de pommes. Il se présente sous forme de poudre cristalline blanche, sans odeur, mais avec une forte tension de vapeur à température ambiante.
Ces dérivés sont des intermédiaires de synthèse industrielle pour la condensation de Knoevenagel ou de Döbner-Knoevenagel, dont on peut découvrir un exemple avec l'acide cinnamique. L'acide malonique sert aussi à la synthèse de l'acide barbiturique et ses dérivés. Poison cellulaire, la molécule entre en compétition avec l'acide succinique de formule HOOC-CH2-CH2-COOH et entrave le cycle de Krebs.
Propriétés
[modifier | modifier le code]À température ambiante, l'acide malonique est une poudre cristalline colorée. Sur le banc Kofler, le corps poudreux fond vers 136 °C, puis s'évapore progressivement. Certaines impuretés revêtant les cristaux, comme l'acide acétique, rendent la détermination du point de fusion fort imprécise.
La poudre est facilement soluble dans l'eau. Elle est également soluble dans la pyridine, l'éthanol, le méthanol et l'éther ou diéthyl éther. Elle n'est pas soluble dans le benzène.
Par chauffage, en présence d'un déshydratant commun du type pentoxyde de phosphore P4O10 ou chlorure de calcium CaCl2, la molécule diacide perd une molécule d'eau et cette élimination ou plus précisément déshydratation donne l'anhydride de l'acide malonique.
Les deux protons acides sont situés sur les deux groupes acide carboxylique, –COOH. La première acidité est relativement forte par la présence d'un groupe attracteur qui est l'autre acide carboxylique en alpha de l'atome de carbone porteur du premier acide. Le proton part facilement car la base conjuguée est ainsi stabilisée par la proche présence du groupe carboxylique restant.
Une décarboxylation est facile, elle conduit à un diol éthylénique, à deux groupes alcool, –OH sur le même carbone, composé nécessairement instable qui se réarrange en acide acétique.
Préparation, synthèses industrielles et usages
[modifier | modifier le code]Produit d'oxydation du jus de pomme, mais aussi isolé dans le suc de betterave à sucre, l'acide malonique est un exemple caricatural de produit chimique naturel et toxique.
Il est synthétisé industriellement en partant de l'acide chloroacétique[4].
le carbonate de sodium génère le sel de sodium de l'acide qui alors réagit avec le cyanure de sodium pour former l'acide cyanoacétique via une substitution nucléophile. Le groupe nitrile est hydrolysé avec de l'hydroxyde de sodium en malonate de sodium dont l'acidification fournit l'acide malonique.
Ce composé est commun dans la synthèse de produits pharmaceutiques.
Les dérivés d'acide malonique, en particulier les esters maloniques qui protègent le groupe acide carboxylique d'une éventuelle dégradation ou favorisent une réactivité dirigée, interviennent dans des synthèses importantes :
- le malonate de diéthyle s'additionne à l'urée par une liaison amide pour former un hétérocycle (l'acide barbiturique) et de l'éthanol. Si le carbone central de l'acide malonique est diversement substitué, on obtient d'autres composés barbituriques ;
- la synthèse malonique permet de fixer sur le carbone central de l'acide malonique une ou deux chaînes carbonées choisies, la suppression d'un des deux groupes acide carboxylique est acquise par chauffage avec une facile réaction finale de décarboxylation après une préalable des estérification.
Pathologie
[modifier | modifier le code]Lorsque des taux élevés d'acide malonique s'accompagnent de taux élevés d'acide méthylmalonique, cela peut indiquer une maladie métabolique appelée « acidurie combinée malonique et méthylmalonique » (CMAMMA). Le calcul du rapport entre l'acide malonique et l'acide méthylmalonique dans le plasma sanguin permet de distinguer la CMAMMA de l'acidurie méthylmalonique classique[5].
Toxicité et règles de sécurité
[modifier | modifier le code]Composé inflammable, aux vapeurs irritantes et nocives
[modifier | modifier le code]L'acide malonique est un produit instable. Chauffé vers 140 °C, il se décompose en fumées toxiques ou en vapeurs potentiellement inflammables. Un début d'incendie peut être arrêté au moyen de poudre CO2, d'agents chimiques secs, de mousses ou d'eau pulvérisée.
Les vapeurs sont irritantes pour les muqueuses, la peau et les yeux. L'acide malonique peut être absorbé par les voies respiratoires et digestives. Il est nocif en cas d'ingestion et fortement irritant pour les conduits pulmonaires.
Il faut éviter un stockage fourre-tout, en présence de bases, d'agents oxydants ou réducteurs.
Inhibiteur biochimique et poison cellulaire
[modifier | modifier le code]L'acide malonique est un inhibiteur enzymatique, analogue structurel. Il entre en compétition avec l'acide succinique lors de la succinate déshydrogénase, étape du cycle des acides tricarboxyliques. Le métabolisme cellulaire est retenu et peut être entravé, ce qui implique des conséquences perturbatrices du cycle de Krebs.
L'acide malonique est un poison cellulaire, fort dangereux du fait de sa solubilité dans l'eau et les liquides physiologiques, ainsi que sa tension de vapeur relativement élevée qui accroît les risques accidentels d'inhalation.
Danger de confusion des appellations triviales
[modifier | modifier le code]Il ne faut pas confondre l'acide malonique et les sels d'anion ou encore les esters couramment nommés malonates, avec l'acide malique et les malates, ou l'acide maléique et les maléates.
L'appellation attribuée par les chimistes provient toutefois d'une même racine, malum en latin, signifiant la pomme en latin, mais les molécules ou les anions diffèrent par leurs structures et leurs propriétés.
Notes et références
[modifier | modifier le code]- ACIDE MALONIQUE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Acide malonique » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009.
- Nathan Weiner, Malonic acid, Org. Synth., coll. « vol. 2 », p. 376.
- Monique G. M. de Sain-van der Velden, Maria van der Ham, Judith J. Jans et Gepke Visser, « A New Approach for Fast Metabolic Diagnostics in CMAMMA », dans JIMD Reports, vol. 30, Berlin, Heidelberg, Springer, (ISBN 978-3-662-53680-3, PMID 26915364, PMCID 5110436, DOI 10.1007/8904_2016_531), p. 15–22.

